John Dalton, 1766-1844
Engelsk videnskabsmand.
Daltons lov foreskriver at det totale tryk i en (ideal)gasblanding er lig med summen af partialtryk fra de gasser, der er i blandingen.
Daltons lov og partialtryk
Tegningen nedenfor illustrerer en beholder der indeholder atmosfærisk luft ved et tryk på 1 bar (1 kg/cm2).
- P = 1 bar
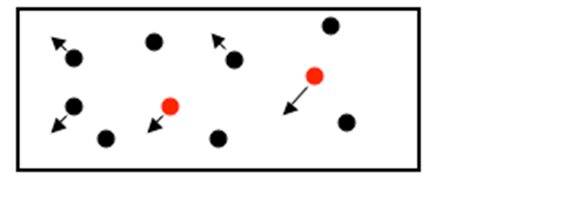
I en gas pisker molekylerne rundt som små bordtennisbolde, de banker hele tiden mod beholderens vægge, og yder dermed et tryk.
Hvor stort et tryk afhænger af to ting: antallet af molekyler, og deres hastighed. Molekylernes hastighed er det vi også kender som temperaturen. I en varm gas bevæger molekylerne sig hurtigt, i en koldere gas langsommere. Beholderen ovenfor indeholder atmosfærisk luft ved et tryk på 1 bar. Luft består af ca. 21 % oxygen (illustreret ved de røde bordtennisbolde) og 79 % nitrogen (illustreret ved de sorte bordtennisbolde). Tilsammen udøver disse molekylers vedvarende banken mod beholdervæggene altså et tryk på 1 bar. Man kan så spørge:
Hvor stor en andel af totaltrykket udøver oxygenmolekylerne (de røde ”bordtennisbolde”)?
Hvor stort en andel af totaltrykket udøver nitrogenmolekylerne (de sorte ”bordtennisbolde”)? Det viser sig, at selvom molekylerne er forskellige, så er de enkelte molekyler lige gode til at trykke. Der er altså ikke forskel på f.eks. oxygenmolekylers ”trykkeevne” og nitro- genmolekylers ”trykkeevne”. Dette er udtrykt i Daltons lov der siger:
”Hvis en gas udgør n % af en gasblanding, så bidrager den også med n % af totaltrykket i blandingen”
Dette tryk kaldes gassens partialtryk.
Eksempel:
Hvad er henholdsvis oxygens og nitrogens partialtryk i beholderen vist på figuren ovenfor?
Da totaltrykket er 1 bar fås:
- Partialtrykket for oxygen: pO2 = 21/100 · 1 bar = 0,21 · 1 bar = 0,21 bar
- Partialtrykket for nitrogen: pN2 = 79/100 · 1 bar = 0,79 · 1 bar = 0,79 bar
Bemærk at partialtrykket for en gas noteres pX, hvor X er den kemiske betegnelse for den pågældende gas, f.eks. pO2, pN2.
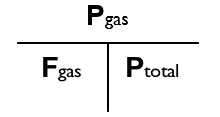
Daltons lov kan mere formelt skrives således:
- Pgas = Fgas · Ptotal
Hvor Pgas er gassens partialtryk, Fgas er brøkdelen af gassen i blandingen, og Ptotal er det totale tryk. Bemærk at Fgas skal være udtrykt som decimaltal, f.eks. 0,21 (svarende til 21%).
Daltons lov i praksis – gassers giftighed, ”tryk-T’et”
Som beskrevet tidligere, er der både en nedre og øvre grænse for, hvor meget oxygen vi kan tåle. Men det er ikke alene oxygen vi kun tåler i bestemte doser. Alle gasser vil blive giftige for os, hvis blot trykket bliver højt nok. F.eks. ved vi som dykkere, at ved dykning med luft dybere end ca. 30 meter, vil de fleste kunne mærke en begyndende nitrogennarkose (dybderus). For at kunne vurdere om en gasblanding er ”sund”, altså om der er for lidt eller for meget oxygen, eller mere nitrogen end vi kan tåle, har vi behov for en måde at måle den ”dosis” af de forskellige gasser vi får, når vi ånder en gas – hertil kan vi benytte partialtrykket.
Partialtrykket for en gas i en gasblanding der indåndes, er et udtryk for den dosis af den pågældende gas, vi får ved hver indånding.
Oxygen
I forbindelse med dykning bør man ikke udsætte sig for et oxygenpartialtryk på over 1,4 bar. Ved overskridelse af denne grænse er der risiko for oxygenforgiftning, hvilket kan medføre epilepsi-lignende krampeanfald og bevidstløshed.
Eksempel:
Hvis vi dykker med luft, hvilket pO2 bliver vi så udsat for på hhv. 20 og 30 meters dybde?
Daltons lov siger:
- Pgas = Fgas · Ptotal
Dvs.
- pO2 = FO2 · Ptotal
FO2 er brøkdelen af oxygen i blandingen, dvs. FO2 = 21/100 = 0,21
P total er totaltrykket i den blanding der indåndes – i første beregning er det tryk- ket på 20 meters dybde, dvs. P total = 3 bar. Således fås et oxygenpartialtryk på 20 meters dybde med luft:
- pO2 = 0,21 · 3 bar = 0,63 bar
På 30 meter fås:
- pO2 = 0,21 · 4 bar = 0,84 bar
Eksempel:
Hvis vi dykker med luft, hvor dybt skal vi så dykke før vi udsættes for et oxygenpar- tialtryk på 1,4 bar?
Dette kan ligeledes beregnes vha. Daltons lov, men for at lette beregningen benyttes det såkaldte ”tryk-T” (også kaldet ”Daltons diamant”), som blot er anden måde at skrive Daltons lov på:
Hvis to af de indgående værdier er kendt, kan man vha. ”tryk-T’et” beregne den sidste. Dette gøres ved at dække for den værdi der ønskes beregnet, herefter fremgår af tryk-T’et hvordan den beregnes ud fra de to andre. Hvis værdierne står ved siden af hinanden skal de ganges med hinanden, hvis værdierne står hhv. over og under den T’ets vandrette streg (tænk på den som en brøkstreg), skal den øverste værdi divide- res med den nederste.
I det aktuelle eksempel kommer tryk- T’et til at se således ud:
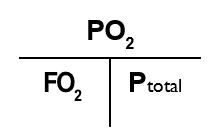
Hvor pO2 = 1,4 bar, og FO2 = 0,21 Og med de aktuelle værdier sat ind:
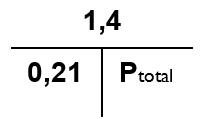
Da det er Ptotal, der ønskes beregnet, fremgår det at resultatet fås ved at dividere 1,4 med 0,21 – dvs.
- Ptotal = 1,4/0,21 = 6,7 bar
Dvs. 57 meter, da trykket på 57 meter er 6,7 bar.
Ved dykning med luft når man maksimalgrænsen for oxygenpartialtrykket på 57 meters dybde. Man vil dog længe før denne dybde blive ramt af en kraftig dybderus, så i praksis vil man som luftdykker ikke dykke så dybt, at man opnår så højt et oxygenpartialtryk.
Nitrox
Nitrox er oxygenberiget luft, dvs. en blanding af oxygen og nitrogen, hvor indholdet af oxygen er større end 21%. Kort fortalt er fordelen ved at dykke med nitrox, at ved at øge oxygenindholdet, så mindskes samtidigt nitrogenindholdet, og som følge heraf optages mindre nitrogen, end med luft, og man kan derfor opnå længere bundtider, uden dekompression, når man dykker med nitrox, end ved dykning med luft.
Ulempen ved nitroxdykning er at risikoen for oxygenforgiftning øges. Lad os beregne den maksimale dykkedybde med en nitroxblanding der indeholder 40 % oxygen. Vi har altså FO2 = 40/100 = 0,4
Tryk-T’et ser således ud:
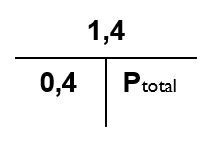
og får således:
- Ptotal = 1,4/0,4 = 3,5 bar – svarende til 25 meters dybde
Hvis man er nitroxdykker, eller er makker med en nitroxdykker, er det således vigtigt at være opmærksom på ikke at overskride nitroxdykkerens maksimaldybde, altså den dybde hvor oxygenpartialtrykket er 1,4 bar. Dette understreger hvorfor det kræver særlig uddannelse for at dykke med Nitrox.
Hvis man er del af et dykkerhold hvor der både er luftdykkere og Nitroxdykker er det vigtigt at huske følgende regel:
Planlæg maksimal bundtid efter luftdykkeren, og maksimal dybde efter Nitroxdykkeren!
CO (kulilte, kulmonooxid)
Som tidligere beskrevet har CO den kedelige egenskab at den kan blokere de røde blod- legemer, således at de ikke er tilgængelige til at transportere oxygen. Dette betyder, at kroppen ikke får den livsvigtige oxygen, selv om der er tilstrækkeligt med oxygen
i åndingsgassen. Følgende tabel viser hvordan påvirkningen af CO afhænger af CO partialtrykket i åndingsgassen.
| pCO (bar) | Effekt |
| 0,00 – 0,03 | Intet direkte synligt ubehag eller vejtrækningsbesvær |
| 0,04 – 0,06 | Tydeligt øget og dybere åndedræt, hovedpine og utilpashed |
| 0,07 – 0,1 | Åndenød og forvirring |
| 0,1 – 0,2 | Voldsom åndenød, bevidstløshed, muskelsitren, kramper |
Lad os antage at vi har en flaske der er blevet fyldt fra en rejsekompressor, og som pga. uagtsomhed er blevet forurenet med 1 % CO.
Hvad er CO partialtrykket i denne gas, hvis den åndes ved overfladen (Ptotal = 1 bar)?
- pCO = FCO · Ptotal = 1/100 · 1 bar = 0,01 bar
Dvs. hvis der åndes fra denne gas ved overfladen så vil dykkeren ikke føle nogen effekt eller ubehag af CO’en.
Lad os tilsvarende beregne CO partialtrykket hvis denne gas åndes på 30 meters dybde (ptotal = 4 bar):
- pCO = FCO · Ptotal = 1/100 · 4 bar = 0,04 bar
På denne dybde vil dykkeren have tydeligt øget åndedræt, hovedpine og være utilpas!
Eksemplet viser at det er ekstremt vigtigt at sikre at åndingsgassen ikke forurenes
med CO.